La radioactivité tout autour de nous

La radioactivité ne se limite pas aux centrales nucléaires. Le thé, les bananes ou les détecteurs de fumée sont aussi radioactifs. Inquiétant ? A vous de juger (spoiler : en fait pas du tout). Image : les noix du Brésil sont riches en radium, un élément radioactif.
Date de publication : 17/01/19
L’atome1,2
Les atomes sont les éléments, les briques qui constituent toutes les matières : le carbone, l’hydrogène et l’oxygène sont des atomes. Les connaissances concernant la composition et les propriétés des atomes étaient encore en débat au début du XXème siècle ! La radioactivité est une connaissance qui viendra plus tard encore et qui demande de connaitre un minimum l’atome.
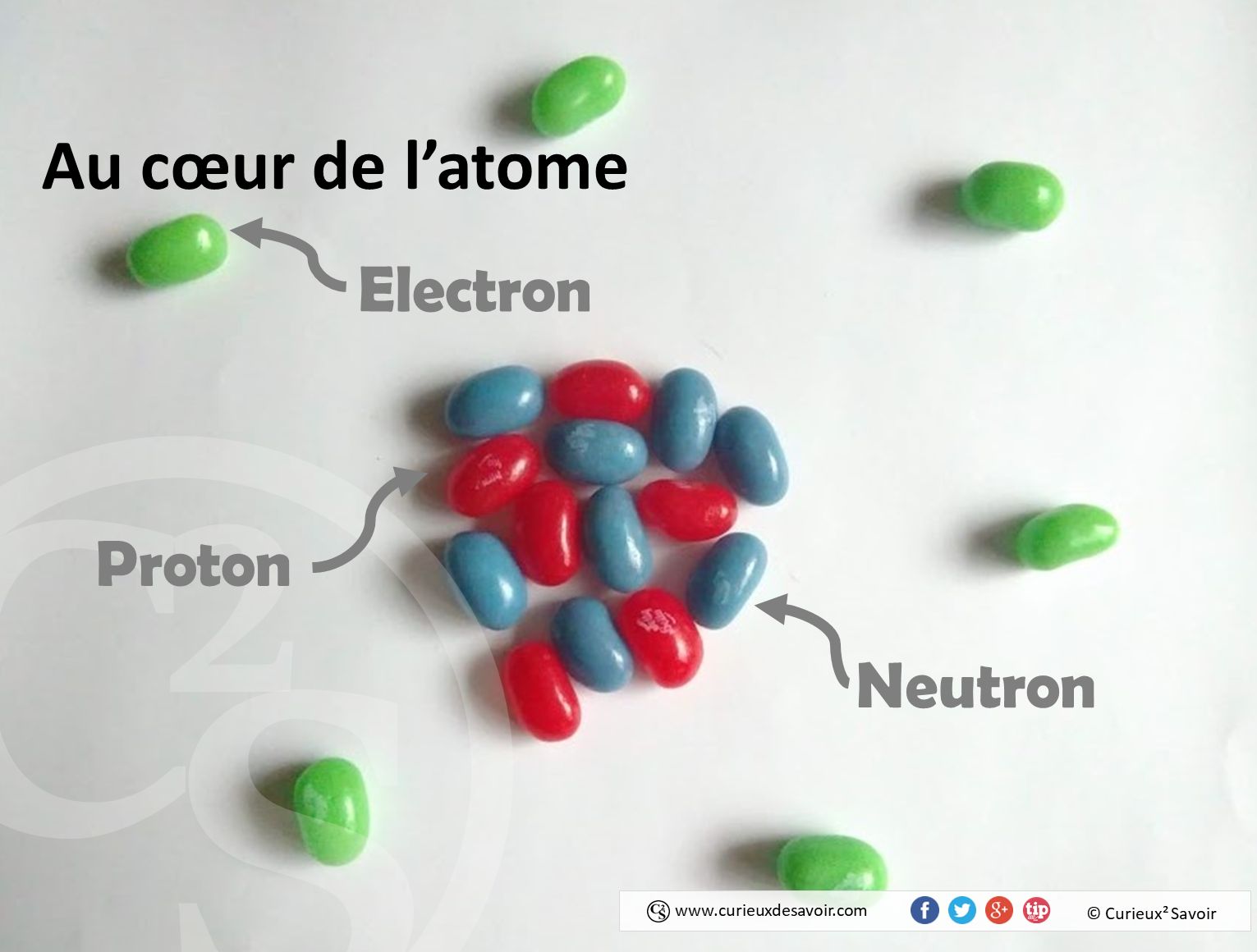
Un atome est comme un sac de bonbons dans lequel il y a des friandises bleues (neutrons) et rouges (protons) : c’est le noyau atomique. Autour de ce sac, des électrons (en vert). Il y a dans cet exemple 8 neutrons et 6 protons, c’est donc un atome de carbone. Il y a dans un atome autant d’électrons que de protons, il y a donc logiquement ici 6 électrons. Ainsi, cet atome de carbone a un noyau qui comprend 8+6 = 14 particules, c’est donc le carbone 14.
A cœur de la matière
Commençons par le génie russe Dmitri Ivanovich Mendeleïev. L’idée géniale de Mendeleïev, même s’il ne fut pas le premier, a été de classifier les atomes selon leurs propriétés physiques et chimiques et leur masse. Mendeleïev ne fut pas le seul à tenter de classer les éléments chimiques, mais c’est lui qui apporta la plus importante avancée. Son classement était tellement visionnaire qu’il lui permit de prédire l’existence d’atomes qui n’avaient pas encore été découverts ! L’Histoire des sciences lui donna 100% raison car on trouva plus tard des éléments dont il avait prédit l’existence, avec les propriétés qu’il avait aussi prédites. Mendeleïev fut capable de comprendre indirectement la composition des atomes en 1865 avant de savoir même de quoi ils étaient faits ! Car la découverte de l’électron par Henry Moseley fut publiée qu’en 1913, celle du noyau par Ernest Rutherford en 1911, puis du neutron par James Chadwick en 1932. En 1913, l’anglais Frederick Soddy découvre que chaque élément peut avoir des isotopes, c’est-à-dire des éléments frères qui comprennent des particules (neutrons) supplémentaires ou déficitaires. L’atome présenté plus haut, le carbone 14 est l’isotope du carbone 12, qui lui ne contient que 6 neutrons (mais toujours 6 protons). Vous l’aurez compris, on associe au nom de chaque atome un chiffre qui indique le nombre de particules dans son noyau. Mais ce n’est pas essentiel à la compréhension de la radioactivité.
Le domaine de la radioactivité s’intéresse aux noyaux (neutrons et protons) de l’atome.
Vers la découverte de la radioactivité
La radioactivité, c’est la propriété des noyaux des atomes à se désintégrer, à mourir, en se transformant en d’autres noyaux d’atomes.
Ce qu’il faut bien avoir à l’esprit, c’est que la radioactivité fut découverte en moins de 50 ans par différentes personnes de manière parcellaire. Exactement comme si vous souhaitez faire un puzzle, à plusieurs, sans qu’aucun ne connaisse l’image finale. A la fin du XIXème siècle, l’Allemand Wilhelm Röntgen découvre par hasard les rayons X et le Français Antoine Henri Becquerel met en évidence la radioactivité un an plus tard en étudiant l’uranium. Le néo-zélandais Ernest Rutherford va plus loin en découvrant la désintégration des éléments et en caractérisant les différentes désintégrations radioactives. C’est là que l’on comprend qu’un atome peut se désintégrer et ainsi se transformer en un autre atome. Nous y reviendrons. Avec l’aide de son époux Pierre Curie, découvre que d’autres éléments que l’uranium sont radioactifs (comme le Thorium), et ils mettront en évidence l’existence d’éléments encore inconnus comme le Radium ou le Polonium.
La radioactivité : mécanismes
La radioactivité est caractérisée la manière dont un élément se désintègre et par le temps pendant lequel il « survit » avant de se désintégrer. Ces deux propriétés sont essentielles pour appréhender le risque radioactif.
La manière : On compte 3 types de désintégrations radioactives : alpha, béta + et béta -.

Le noyau de l’atome présenté (à gauche) perd 2 protons et 2 neutrons (soit un noyau d’hélium) : c’est la radioactivité alpha (a). Une énergie est libérée lors d’une désintégration alpha due au recul que subit le noyau suite à la libération du noyau d’hélium. Exactement comme le recul d’un fusil une fois une balle tirée.
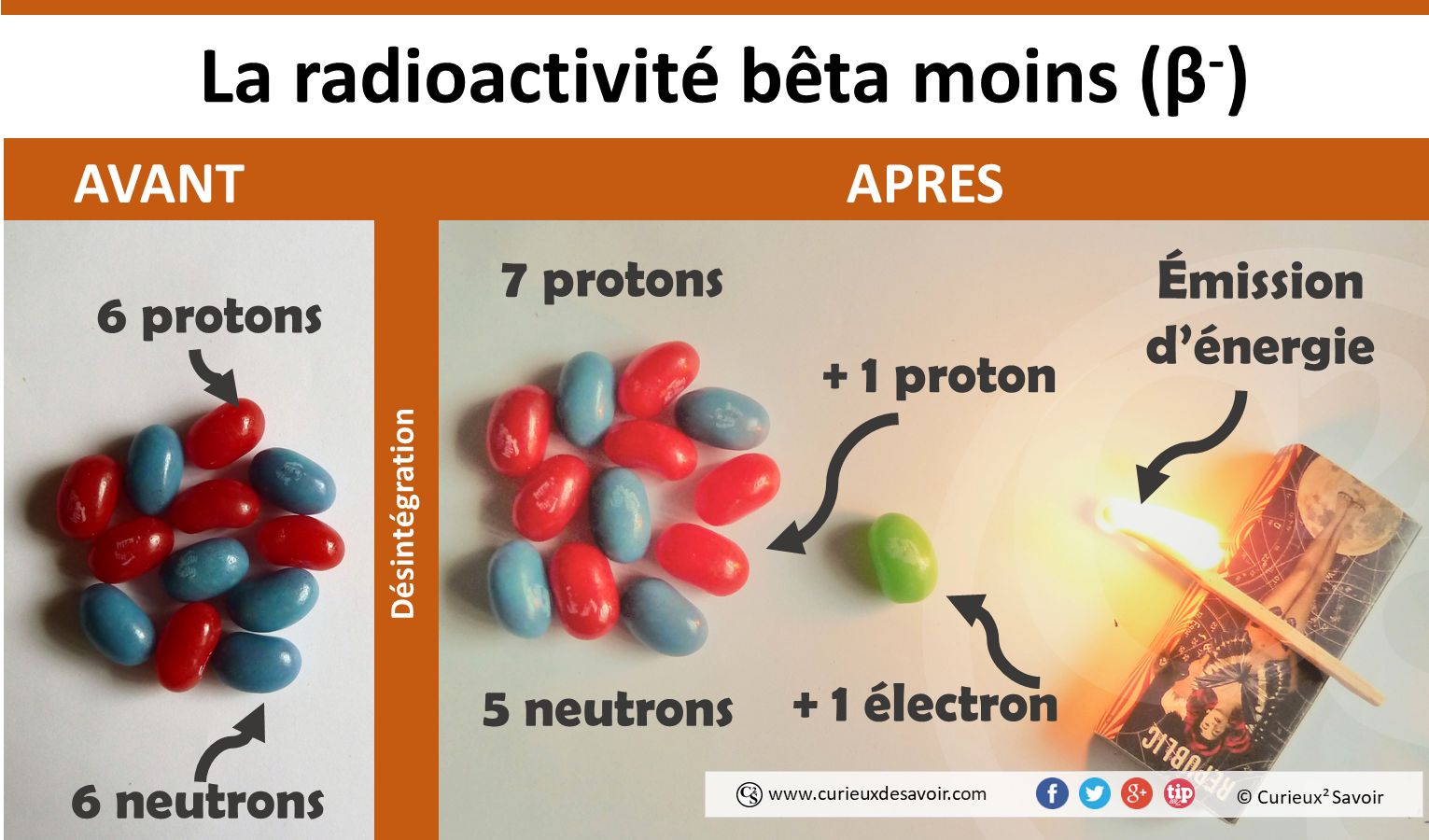 Le noyau perd un neutron et gagne un proton : radioactivité bêta moins (β-). Il y a en plus une émission d’énergie radioactive sous forme de « lumière » non visible. Une énergie du même type que les rayons UV, mais encore plus énergétique.
Le noyau perd un neutron et gagne un proton : radioactivité bêta moins (β-). Il y a en plus une émission d’énergie radioactive sous forme de « lumière » non visible. Une énergie du même type que les rayons UV, mais encore plus énergétique.
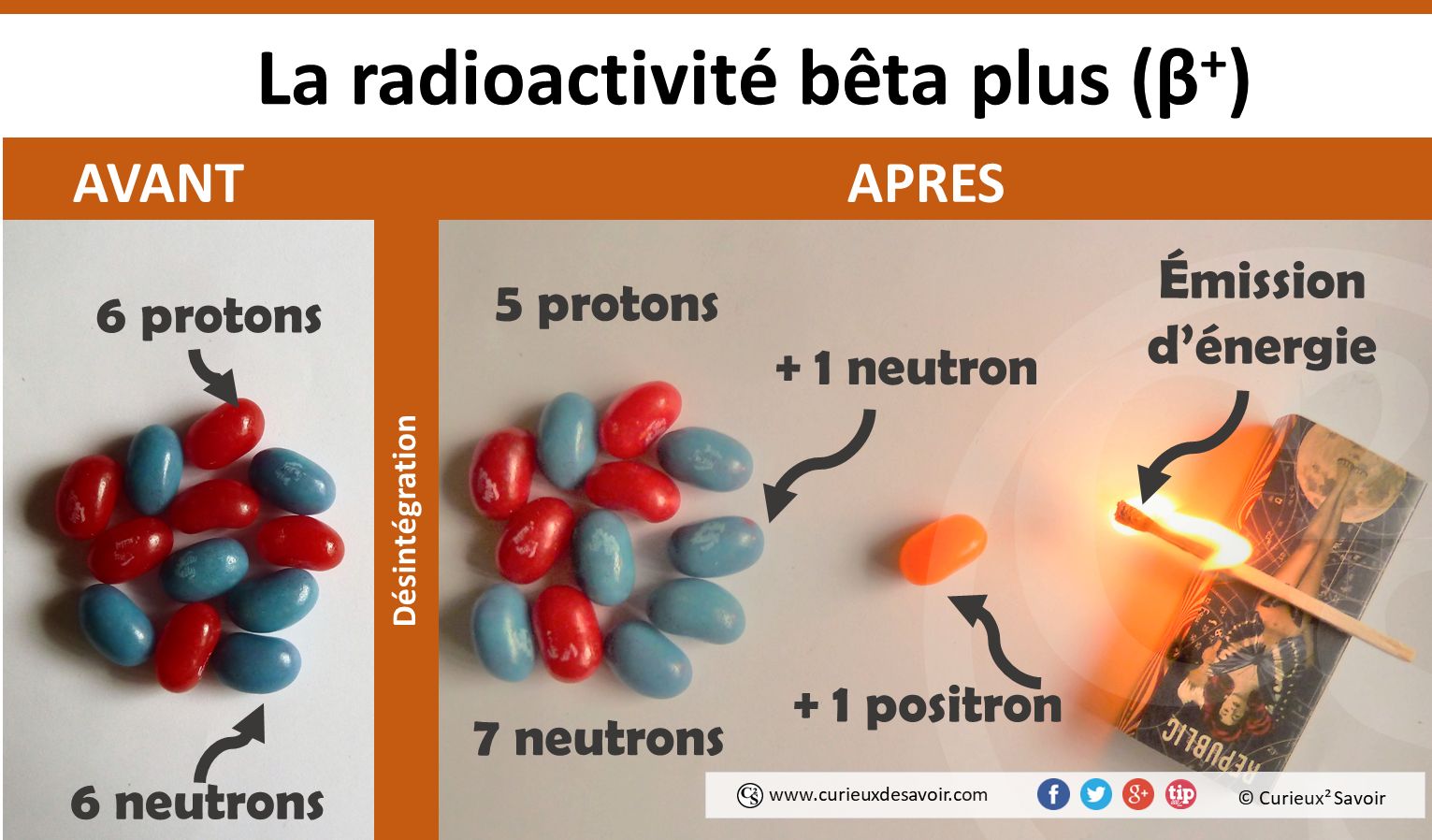 Le noyau perd un proton, gagne un neutron et émet un positron (une particule un peu exotique) : radioactivité bêta plus (β+). Il y a en plus une émission d’énergie radioactive sous forme de « lumière » non visible. Une énergie du même type que les rayons UV, mais encore plus énergétique.
Le noyau perd un proton, gagne un neutron et émet un positron (une particule un peu exotique) : radioactivité bêta plus (β+). Il y a en plus une émission d’énergie radioactive sous forme de « lumière » non visible. Une énergie du même type que les rayons UV, mais encore plus énergétique.
On peut ajouter les émissions gamma (g), qui sont la conséquence des désintégrations. Vous voyez comme les bonbons ont bougés les uns par rapport aux autres au sein du noyau ? L’atome qui s’est désintégré est tout chamboulé et émet une radiation pour se calmer de son changement. Concrètement ces émissions d’énergies radioactives sont des émissions dites rayonnantes, une lumière qui n’est pas visible et neutre en énergie.
Le temps : Si l’on prend une poigné d’Uranium 238, on sait que la moitié se sera désintégrée en 4,4 milliards d’années. Pour le césium 137, cela prendra 30 ans. On appelle cette caractéristique la période de désintégration radioactive. Cependant, on ne sait pas quel atome en particulier va se désintégrer, on ne sait que prédire la désintégration à l’échelle de très nombreux atomes.
Suivant leur nature, les noyaux des atomes se transforment de différentes manières et dans des intervalles de temps spécifique. Lors de cette transformation, de l’énergie est libérée. Concrètement, cette énergie peut avoir des conséquences sur les êtres vivants avec une mortalité aigue, ou à long terme en dégradant l’ADN.
La radioactivité : la mesurer
Le becquerel correspond au nombre de désintégrations radioactives par secondes. Une désintégration par seconde = 1 becquerel. Et ceci quel que soit le type de désintégration. C’est souvent comme cela que l’on se représente la radioactivité, avec un compteur qui crépite : crrrrrr. Le Curie (Ci) est une unité de désintégration où 1 Ci = 3,7×1010 becquerels.
Les unités liés à la radioactivité. 1 Röntgen Equivalent Man (REM) = 0,010 Sievert. Une dose unique supérieure à 1 Gray est mortelle, 1 Gray = 100 REM = 1 Sievert (Sv).
C’est quoi un élément radioactif dangereux ?3
La conséquence de la radioactivité est que les rayonnements et les particules émis peuvent provoquer des dommages sur les tissus vivants (un bombardement à l’échelle de la matière). Si la dose est forte, la mort est instantanée ou peut prendre plusieurs jours. Mais les doses auxquelles l’humain est le plus souvent exposé sont dommageables à long terme avec l’apparition de cancers. Selon le type de radioactivité (b-, b+, a, g), les conséquences ne sont pas les mêmes sur les cellules. Suivant la quantité de ces rayonnements, les conséquences seront aussi différentes. Concrètement, le danger d’un atome d’uranium ne sera pas le même si on l’ingère ou si on y est exposé de manière externe. Et ces radiations n’auront pas les même conséquences que celles d’un atome de carbone 14. Pour prendre cela en compte, on utilise une autre unité de mesure : le Sievert (Sv). Un Sievert correspond à 5,5% de risque de cancer supplémentaire, calculé d’après un modèle qui prend en compte l’effet néfaste spécifique de chaque type de radioactivité.
La radioactivité naturelle
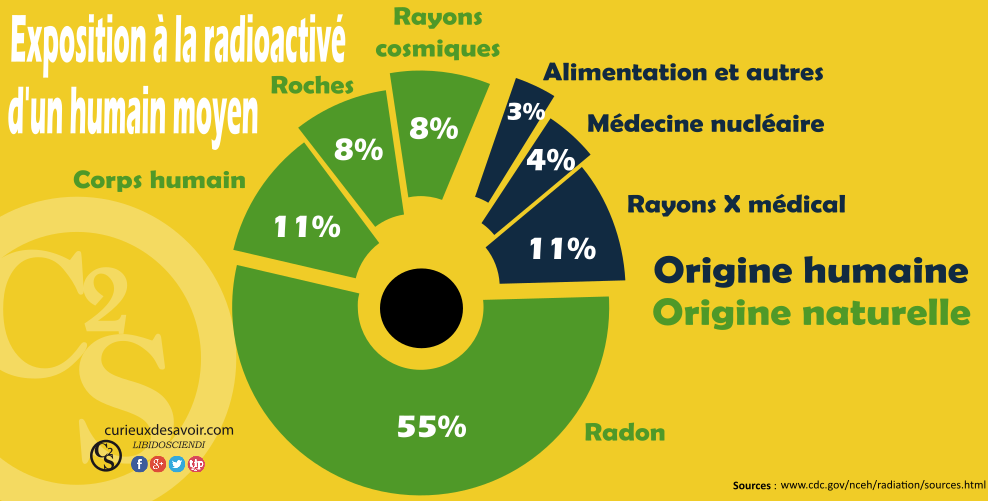
Pour la petite histoire, il existe d’autres manières de mesurer la radioactivité, parfois à la limite de la provocation ! Il y a par exemple la dose équivalente banane (BED)… En effet, la banane contient du potassium radioactif (40K ou potassium 40). Un BED correspond à 2,3 µSv (0,0000023 Sv), mais son effet ne se cumule pas. En effet, le potassium ingéré ne s’accumule pas dans le corps, il y a un équilibre entre les entrées… et les sorties. Bref, il faudrait 35 000 000 BED pour atteindre une dose létale4,5. Oui, il faudrait manger 35 millions de banane, en une fois, pour mourir via la radioactivité qu’elle contient. A priori, une mort par étouffement surviendrait avant… Cette unité n’a bien entendu rien d’officiel, mais elle permet de sensibiliser au fait que radioactivité fait partie de notre environnement naturel et de prendre conscience que ces expositions sont parfois tellement basses qu’elles sont proches de celles venant d’une banane. Le mot radioactivité fait souvent peur et les unités Becquerel ou Sievert sont dénuées de sens pour le commun des mortels. La BED permet de mieux se les représenter.6,7 Les roches, l’eau et la nourriture sont aussi radioactifs et nous y sommes exposés continuellement.
La banane n’est pas le seul aliment qui soit naturellement radioactif. La radioactivité des aliments et des plantes est due aux éléments radioactifs qui les constituent. Ceci peut provenir de deux mécanismes :
- Les plantes puisent dans l’air ou les sols des éléments essentiels à leur constitution comme le potassium ou le carbone. Naturellement, des isotopes de ces éléments sont radioactifs comme le potassium 40 (40K) et le carbone 14 (14C). La noix du Brésil, tout comme la banane, sont très riches en potassium, et donc inévitablement en potassium radioactif (potassium 40) qui est présent sur Terre naturellement.
- Les plantes puisent dans l’air ou les sols des éléments de manière accidentelle. En effet, certains éléments ont des propriétés physico-chimiques très proches de celles des éléments essentiels et trompent les plantes. Ainsi, la noix du Brésil est aussi riche en radium (226Ra et 228Ra) qui a des propriétés physico-chimiques proches de celles du magnésium et du calcium4,8. Les noix du Brésil émettent environ 500 Bq pour 1 kg (Bq/kg)9,10 provenant du radium.
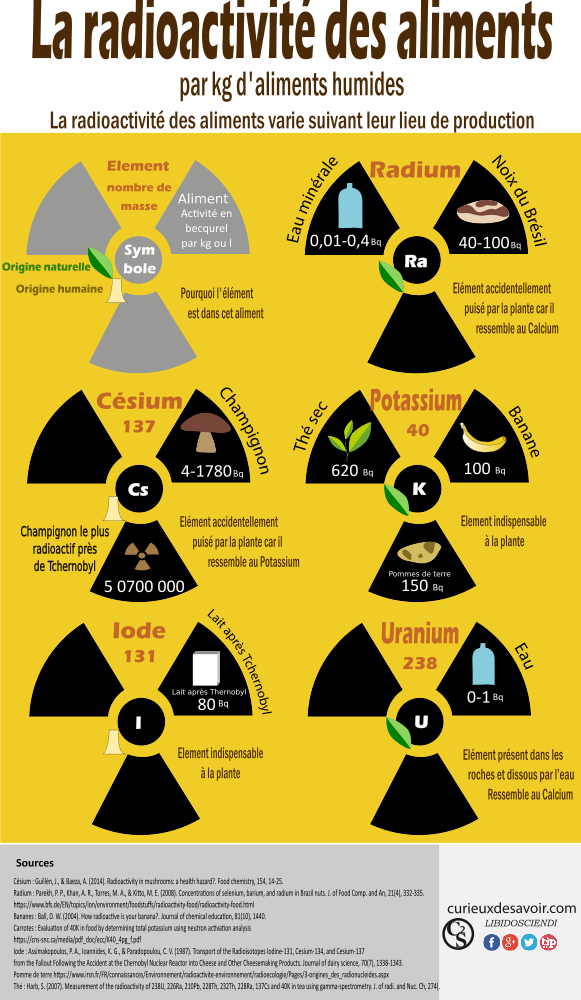
Radioactivité de certains aliments
Le césium 137 (137Cs), qui est un polluant issu des accidents nucléaires, est aussi retrouvé dans les plantes car il a des propriétés physico-chimiques très proches de celles du potassium et du sodium. La plante le puise dans le sol à cause de cette ressemblance11. Certains sels de table contiennent aussi du radium, et le tabac est riche en thorium, polonium et uranium12.
Au bout de la chaine, le corps humain est radioactif lui aussi, notamment à cause du potassium 40, du sodium 22 et du carbone 14 qui nous composent.
Un humain émet environ 8000 Bq ! Oui, chaque seconde votre corps génère 8000 désintégrations : le programme minceur naturel…13–15
La radioactivité des sols
Ce n’est pas l’alimentation qui est la source la plus importante d’exposition à la radioactivité naturelle. La plus importante est… le sol. Les roches comme le granite sont riches en uranium (U) et thorium (Th). Mais ce ne sont pas vraiment eux le problème. Lors de leur désintégration, du radon (Ra) est créé, qui, lui est très radioactif : il a une demi-vie de 4 jours. Plus embêtant encore, le radon est un gaz. Dans certaines régions, il peut s’accumuler dans les caves des maisons. Aux Etats-Unis où l’aménagement des caves (« basement » en américain) est courant, les habitants en respirent en permanence. Ainsi, le radon est la deuxième cause de cancer du poumon après la cigarette. Une manière facile de diminuer les risques consiste simplement à aérer convenablement les basements.16 Suivant le type de roches d’un site, la radioactivité peut varier, ainsi des régions comme la Bretagne peuvent être « très » radioactives. Dans le monde, des régions comme les côtes du Kerala en Inde ou Ramsar en Iran présentent des fortes doses de radioactivité. Malgré ces fortes doses, ces régions ne présentent pas d’excès de gens malades (leucémies par exemple)17. On peut aussi citer le césium 137 qui se retrouve encore dans les sols français de nos jours suite à l’accident de Tchernobyl. Dans les sols de forêt on le retrouve plutôt en surface dans les 20 premiers centimètres, et il reste un contaminant anthropique majeur. Cependant, sa contribution à la dose radioactive reçue par chaque français est mineure.

Certaines populations du monde peuvent atteindre une dose de radioactivité de 7 mSv par an (milisiverts). Pour comparer, un français reçoit chaque année entre 0,4 mSv et 3,1 mSv et la dose annuelle acceptable est fixé à 10 mSv.18
Les services rendus par la radioactivité !
Il y a bien entendu les horloges atomiques, mais nous ne parlerons pas d’elles, ni des centrales nucléaires. Après être descendus à la cave, levons les yeux aux plafonds avec les détecteurs de fumée : savez-vous qu’ils fonctionnaient avec de l’américium 241 ? Ces détecteurs en contenaient un microgramme ! Les particules alpha créés lors de sa désintégration traversaient l’ai et avaient pour effet de créer des particules chargées. En temps normal, une petite décharge émise par une pile passait à travers l’air grâce à la présence de ces particules. Une éventuelle fumée interrompait le passage du courant en absorbant ces particules chargées, ce qui déclenchait. Ce système est maintenant remplacé par une LED et c’est l’opacité de la fumée qui fait rôle d’interrupteur. Ce n’est pas la dangerosité de ce microgramme d’américium dans les détecteurs qui posait problème, mais plutôt son accumulation dans les décharges.
Conclusions
- La radioactivité est présente naturellement, même si des éléments radioactifs peuvent être créés artificiellement.
- Cette radioactivité est présente dans les aliments principalement à cause du carbone 14, du potassium 40 ou encore du radium.
- La radioactivité des aliments est puisée soit accidentellement car l’élément ressemble à un autres, soit car l’élément puisé contient naturellement des éléments radioactifs.
- Le corps humain émet près de 8000 désintégrations par secondes !
Phosphoré par : Gontier Adrien, Jaeger Catherine
Mots clefs : radioactivité, aliments, sols