Molécules aux îles Féroé

Visite des îles Féroé à travers les molécules qu’on y rencontre. De la fleur nationale aux bonbons étranges, explorez l’archipel spectaculaire et attachant par ses molécules qui lui donnent ses couleurs et ses goûts.
Date de publication : 08/11/23
Les îles Féroé, au nord de l’Ecosse, forment un pays rattaché au Danemark composé de 18 îles et peuplé de 50 000 habitants. Pour en savoir plus vous pouvez consulter cet article : Sciences aux îles Féroé. Illustration, boutons d’or sur les hauteurs de Tjørnuvík.
Salmiak, le chlorure d’ammonium dans les bonbons
Les îles Féroé, au nord de l’Ecosse, forment un pays rattaché au Danemark composé de 18 îles et peuplé de 50 000 habitants. Pour en savoir plus vous pouvez consulter cet article : Sciences aux îles Féroé. Illustration, boutons d’or sur les hauteurs de Tjørnuvík.
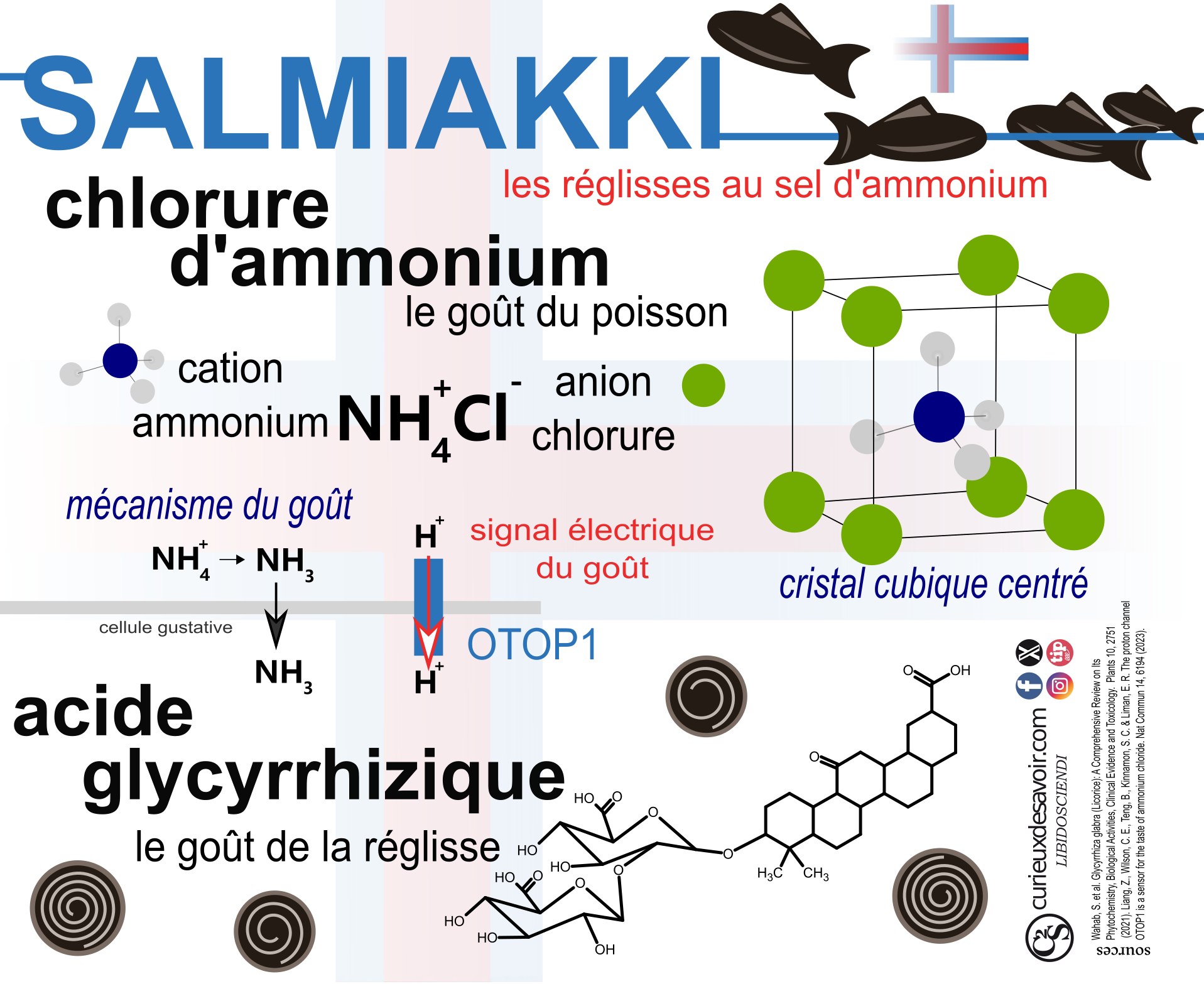
L’idée même de cet article me vient de la dégustation d’un bonbon noir en forme de poisson, saupoudré d’une poudre blanche. Le bonbon est à base de réglisse, et les pays nordiques consomment 80% de la production mondiale de réglisse1, même si les Pays Bas en sont champions d’Europe de production et de consommation2. Ce n’est pas tant le goût caractéristique de l’acide glycyrrhizique, 50 fois plus sucrant que le sucrose3 et dont je parlerai un peu plus loin, qui fut dans cette dégustation un problème. Ni le sel qui accompagne souvent les friandises à base de réglisse dont sont friands les nordiques. Après quelques secondes, un goût de poisson me prend. Il devient de plus en plus présent et se transforme en goût ammoniaqué. En respirant, on sent passer l’ammoniaque par la bouche et les narines. C’est à mon goût spécifiquement mauvais, c’est très fort. La raison : le chlorure d’ammonium, aussi appelé salmiak de formule NH4+Cl-.
 Rayon de bonbons dans un supermarché
Rayon de bonbons dans un supermarché
Ces friandises au goût de réglisse et de sel d’ammonium sont appelées « Salmiak » ou « Salmiakki ». L’écrivain Mark Binelli4 décrit dans le New York Times : « La réglisse a un goût agressif, ce qui pourrait sembler positif si cela apportait une possible harmonie. Mais ce goût ne faisait qu’accentuer un arrière-goût chimique de rance, une combinaison de cola sans sucre, de dentifrice au fenouil et de glutamate de sodium que plusieurs gorgées d’eau ne parvenaient pas à atténuer ». Je confirme, ça colle aux dents. Au Danemark, les produits à base de réglisse contenant plus de 5% de chlorure d’ammonium sont étiquetés comme "réglisse pour adultes - déconseillée aux enfants".
 Bonbons au chlorure d’ammonium : poissons Haribo Salt Sild / Salty Licorice Fish.
Bonbons au chlorure d’ammonium : poissons Haribo Salt Sild / Salty Licorice Fish.
Mais pourquoi un tel mélange ? La réglisse, qu’on cultive en Asie de la Turquie à la Chine3, est extraite des racines de l’espèce végétale Glycyrrhiza. Elle tient son goût particulier de l’acide glycyrrhizique. On attribue à cette saponine des bienfaits thérapeutiques depuis près de 4000 ans en Asie5, et ceci pour de nombreux maux : propriétés anti-inflammatoires, anti-ulcéreuses, et actions antivirales. La combinaison de la réglisse avec le chlorure d’ammonium a peut-être été pour la première fois utilisée comme remède contre la toux et les maux de gorge.
Cependant ce mélange n’est pas forcément en odeur de sainteté à l’EFSA (Agence européenne de la sécurité alimentaire). En effet, le chlorure d’ammonium peut provoquer une décalcification des os et son utilisation en Union européenne dans les aliments est limitée à hauteur de 3g par kilogramme de produit (soit 0,3% du produit fini)...sauf dans le domaine de la confiserie justement où elle peut atteindre 7% de la masse totale. On en est tellement fan dans les pays nordiques que certaines personnes ont voulu voir un lien entre le peu de cas COVID et la consommation de salmiak pendant la pandémie de 20206.
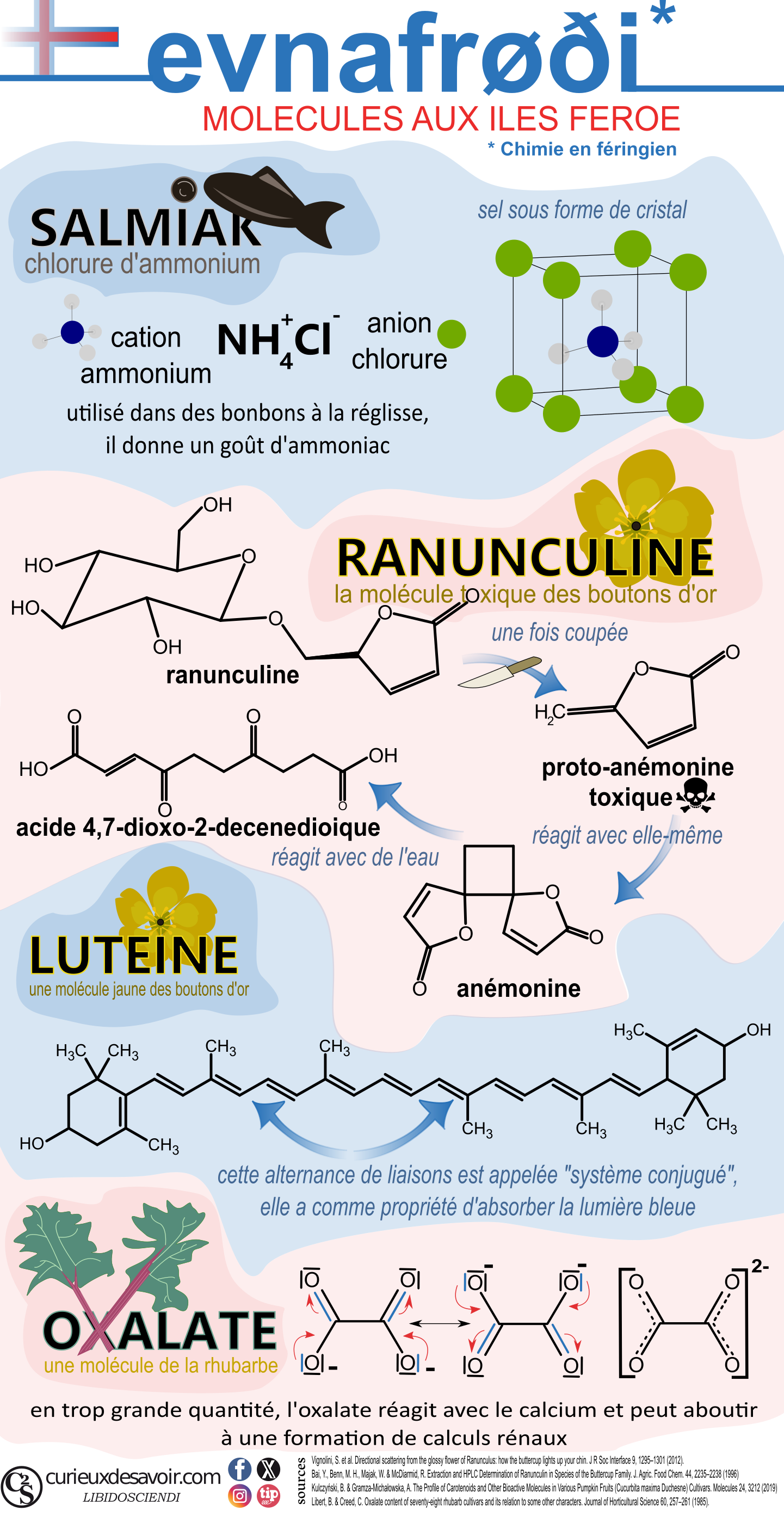
Mais qu’est-ce qui fait du salmiak un additif avec un goût si particulier ? Ce sel d’ammoniac est premièrement composé d’un ion positif d’ammoniac, soit le cation NH4+. C’est l’acide conjugué de l’ammoniac NH3. Ensuite, le contre ion de ce sel est l’anion chlorure Cl-. C’est un atome de chlore qui a gagné un électron, d’où sa charge électrique négative. Les deux ions sont liés par des charges électriques de type ionique, les mêmes que dans le sel de table, qui font que les sels sont solides sous forme de cristal. Mais une fois dans l’eau, les ions se dissolvent. L’eau, H2O, se comporte comme un aimant qui va entourer le sel. Les parties de l’eau composées d’hydrogène H sont un peu chargées électriquement positivement et les parties d’oxygène sont un peu chargées négativement. Face à ce flot de molécules d’eau, le sel commence à se dissocier et les liaisons ioniques vont se casser. L’eau va ensuite entourer les ions qui se sont séparés, c’est la solvatation. Puis les ions vont se disperser dans la solution. Et voilà nos ions ammonium et chlorure dissous.
Une équipe de chercheurs de Californie et du Colorado ont modifié quelques souris pour percer le mystère du goût du salmiak7. Les bourgeons gustatifs sur la langue comportent 50 à 100 cellules réceptrices au goût. Les cellules de type II détectent l’amer, le sucré ou l’umami, tandis que les cellules de type III détectent les stimuli acides. Ces dernières sont activées par un canal à protons nommé OTOP1. On rembobine l’histoire…le chlorure d’ammonium, salmiak, de formule NH4Cl, est sur la langue. Dans la salive, des réactions chimiques très rapides font passer l’ammonium (sous forme dissoute dans l’eau NH4+) à gazeux (ammoniac NH3). Ce dernier passe à travers la cellule gustative. Il y a alors une série de réactions chimiques qui font baisser l’acidité à l’intérieur de la cellule. Pour se rééquilibrer, un proton passe de l’extérieur à l’intérieur de la cellule par un canal appelé OTOP1. Ce passage créé alors un signal électrique, interprété comme un goût par le cerveau.

Illustration : Tyrkisk Peber, bonbon à la réglisse, au poivre et au chlorure d’ammonium (salmiak)
Bouton d’or toxique (glycoside ranunculine)
Les routes « buttercup », c’est à dire « bouton d’or », indiquent aux îles Féroé les routes avec un paysage particulièrement beau. A peine croyable vu que tout est beau aux Féroé, mais passons. Sólja en féringien, ou renoncules (Ranunculus repens, Ranunculus acris, Ranunculus acer) en français, est connu sous le nom vernaculaire de bouton d’or. C’est la fleur nationale des îles Féroé8.
 Panneau de la funningsleið, « leið », le chemin vers Funningur (île d’Eystyroy)
Panneau de la funningsleið, « leið », le chemin vers Funningur (île d’Eystyroy)
 Boutons d’or dans les hauteurs de Tjørnuvík
Boutons d’or dans les hauteurs de Tjørnuvík
Mangée fraîche, la fleur est toxique à cause d’une molécule qu’elle contient : la ranunculine9,10. Ainsi, le contact avec une plante coupée peut provoquer des démangeaisons ou des éruptions au niveau de la peau ou des muqueuses. L’ingestion de la toxine peut entraîner des nausées, des étourdissements, des spasmes, une hépatite aiguë, une jaunisse et jusqu’à une paralysie. Le poison attaque les protéines des cellules et l’ADN. C’est pour cela que la plante est un problème pour les agriculteurs car les bovins peuvent les manger11.
Mais ce n’est en fait pas cette molécule de ranunculine qui est toxique, c’est un produit de sa décomposition. En effet, la ranunculine est une molécule qui est faite de deux parties, dont une qui est un sucre, c’est pour ça qu’on dit que cette molécule est un glucoside. Lors de la découpe de la fleur, des enzymes décomposent la ranunculine en sucre et protoanémonine. C’est cette dernière molécule, la protoanémonine qui est qui est toxique. Cette molécule est aussi appelée ranunculol ou anemonol, car elle se retrouve aussi dans les anémones.

Village de Kirkjubøur (île de Streymoy)
Lorsque la plante est séchée, la protoanémonine entre en contact avec l’air et dimérise en anémonine. Cela veut dire que la molécule fusionne avec une molécule identique. Au cours du séchage, ce dimère est hydrolysé (c’est-à-dire réagit avec de l’eau) pour donner un acide dicarboxylique non toxique12,13.
Bouton d’or au beurre (la lutéine)
Le bouton d’or a d’autres secrets. Tu aimes le beurre ? Vous connaissez peut-être ce jeu d’enfant qui consiste à mettre une fleur sous le menton de quelqu’un en lui demandant s’il aime le beurre. Si on voit le reflet jaune des pétales, la réponse est alors oui. Des scientifiques se sont penchés sur la question de la lumière jaune qui se reflète sur les pétales des boutons d’or14,15.
En résumé, c’est la structure du pétale qui lui donne cet aspect jaune brillant. La structure du pétale permet d’abord à la lumière du soleil d’être filtrée deux fois, ce qui lui donne cette couleur jaune intense. Ensuite, la structure du pétale a aussi la propriété de renvoyer cette lumière jaune dans une direction précise, donnant un effet brillant caractéristique. Voici comment ça se passe.
La surface du pétale du bouton d’or est faite de trois couches : la première contient des pigments de la grande famille des caroténoïdes. Ces pigments sont de longues molécules linéaires conférant des couleurs qui vont du jaune au rouge, et qui sont souvent mélangées.
Dans le bouton d’or, c’est probablement la lutéine qui est le caroténoïde le plus courant, c’est la même molécule qui donne sa couleur au jaune d’œuf et au maïs16,17. Dans le bouton d’or, le b-carotène (orange) peut aussi être présent, tout comme la zéaxanthine (jaune).
En réalité, ces pigments ont une structure très similaire, seules leurs extrémités varient un peu et leur taille. C’est leur partie centrale, avec une structure particulières appelée système conjugué en chimie qui leur confère leur propriété colorante. En effet, un système conjugué est une portion de la molécule où les électrons se baladent allégrement. Or, plus le chemin est long pour se balader, plus la molécule absorbe des lumières de longueurs d’onde très énergétiques telles que le violet, ainsi ces molécules nous apparaissent dans des tons jaune-rouge (pour compléter les explications sur le système conjugué et la chimie des couleurs, voir article sur le site).
Au final, dans la fleur, le mélange de pigments a la propriété d’absorber les lumières de longueurs d’ondes comprises entre 400 et 500 nm de couleur violette et bleu. Cette propriété a comme conséquence de filtrer la lumière blanche du soleil qui contient l’ensemble des couleurs de l’arc en ciel. Ainsi, en absorbant la portion violette du spectre de la lumière, les pigments laissent repartir les autres lumières qui auront une apparence jaune. C’est le principe des couleurs complémentaires.

La lutéine est le principal pigment du bouton d’or. Il filtre la lumière du soleil qui est aussi reflétée par une couche d’amidon dans le pétale.
Première étape franchie : la lumière blanche du soleil qui a traversé cette couche est désormais jaune. Puis la lumière va passer à traverse une fine couche d’air de 0,5 µm à l’intérieur du pétale pour enfin rebondir sur une couche d’amidon épaisse de 7µm. En effet, l’amidon a la propriété de diffuser fortement les ondes lumineuses par réflexion. Ces ondes lumineuses réfléchies vont alors traverser la couche d’air à nouveau, puis repasser à travers les pigments et être à nouveau filtrées. La couche d’air par-dessus la couche d’amidon forme une surface plane, ce qui permet à la lumière de repartir dans une direction unique. En effet, si on regarde un reflet à la surface de l’eau, il sera net si la surface est plane. La raison est que les rayons de lumière sont reflétés dans la même direction.

Vár Bryggj, brassée par Föroya Bjór est une bière de printemps avec comme symbole le bouton d’or

Bouton d’or à Gásadalur (île de Vágar)
Rhubarbe et l’acide oxalique
De nos jours, la plupart des denrées alimentaires sont importées dans les îles. Les Féroé sont exportateurs de poissons (cabillaud, saumon d’élevage) et produisent ou chassent pour la consommation locale des oiseaux de mer, de la viande de baleine, du mouton (80000), des vaches (100018) et des oies (100019). D’un point de vue des végétaux, on compte principalement la pomme de terre, les carottes sur l’île de Sandoy (grâce à un sol sableux), les choux feuilles et choux raves et les poireaux. Les Féroé ne sont pas autosuffisants en nourriture : ces cultures sont présentes ici et là dans des jardins ou très rarement en champs pour la vente comme à Sandoy. La rhubarbe et quelques baies (cassis, groseilles à maquereau) sont les seuls fruits cultivés dans les jardins féringiens à titre personnel.


Champs à Sandur (Sandoy)
La rhubarbe a une teneur élevée en vitamine C (12mg/100g, le citron est à environ 50mg/100g). Elle est aussi riche en fibres. Les fibres sont des polysaccharides (qui sont en fait des assemblages de sucres simples), telles que la cellulose ou les pectines auxquelles se rajoutent les lignines (famille des fibres de bois). La propriété principale des fibres est finalement qu’elles ne peuvent pas être digérées20. En effet, l’amidon du blé par exemple, est aussi un sucre composé, mais l’amidon est digéré par notre organisme qui va le couper en petits morceaux, en sucres simples. Les fibres ne le sont pas : ce sont des résidus de cellules des aliments que nous mangeons qui peuvent être solubles ou non, mais qui ne sont pas décomposées21. Cette propriété leur donne un pouvoir d’action mécanique et chimique qui régule l’absorption des nutriments et influence le microbiote intestinal. Ces mécanismes ont au final un effet positif contre le cancer du côlon, le diabète, l’obésité ou encore les maladies cardiovascualaires22-24.

Carré de rhubarbe (rabarba) dans un jardin
La rhubarbe a aussi la particularité de contenir de l’acide oxalique (H2C2O4)25, un acide qu’on trouve aussi en grande quantité dans le persil, l’oseille ou la carambole. Lors de son ingestion, l’acide oxalique passe par l’estomac qui est très acide (pH de 1,0 à 2,5). Dans l’estomac, l’acide oxalique se dissout. De là, le liquide de digestion de l’estomac (au doux nom de chyme) passe dans l’intestin grêle qui a par contre un pH basique (compris entre 6,5 et 8). À ce niveau, une partie de l’acide oxalique passe sous sa forme basique : l’ion oxalate (C2O42−) qui peut alors se lier à des minéraux sous forme de cation tels que le magnésium ou le calcium26 (Ca2+, Mg2+). Les cristaux à base de calcium ainsi formés (CaC2O4), appelés weddellite, sont peu solubles dans l’eau et peuvent entraîner des calculs rénaux. L’oxalate est donc toxique pour les reins (néphrotoxique) : un humain de 65kg ne peut en ingérer plus de 25g25,27! Qu’on se rassure, la plus grande concentration d’oxalate est dans les feuilles de la rhubarbe. C’est bien la feuille qui pose problème et non les tiges qui ne contiennent pas une dose d’oxalate suffisamment élevée pour aboutir à ces complications27. Par contre, en se fixant au calcium, l’oxalate réduit sa biodisponibilité. En d’autres termes, une consommation trop riche en oxalate peut aboutir à une déficience en calcium.
Il est à noter que les feuilles présentent également une toxicité pour les animaux. Elles sont utilisées en apiculture pour combattre le varroa.


Le goûter classique des Féroé : une gaufre avec de la chantilly et de la confiture de fraise-rhubarbe (Valfur við rómi og súltutoy), et un kaffi !
Phosphoré par : Gontier Adrien, Jaeger Catherine
Mots clefs : Féroé, Molécules, Fleur, Bonbon