Les colorants alimentaires
Pourquoi les utilise-t-on et d’où viennent-ils ? Peuvent-ils avoir des effets indésirables ? Pourquoi le colorant colore ?
Date de publication : 30/12/15
Colorer les aliments, pourquoi ?
Car on mange avec ses yeux. La couleur est extrêmement importante pour le goût et la perception de ce que l’on mange. Elle serait plus importante que la saveur et la texture dans la détermination à fois de la qualité de la nourriture et de sa nature. Une belle couleur nous donne l’impression du bon et peut nous tromper sur les véritables arômes présents dans l’aliment. Pour vous en convaincre, je vous propose un test à faire dans la partie expérience de cet article (lien à la fin de l’article ou sur le bandeau de droite).
De nos jours les personnes cherchent plutôt le « vrai ». C’est-à-dire la vraie couleur de l’aliment « naturel ». Pourtant, dans le cas d’une alimentation récréative (bonbons etc.), les couleurs fantasques ne choquent pas. Les industriels doivent donc jouer aux équilibristes avec les couleurs! Ainsi, le ketchup vert de Heinz sera un succès, le Pepsi blanc sera un échec !1
La coloration alimentaire : histoire, abus et réglementations
La quantité de colorant ingérée par personne et par jour est passée de 12 milligrammes en 1950 à 61 milligrammes en 20102! La coloration artificielle de nos aliments en est-elle moderne pour autant ? Non et loin de là.
Le cuisinier royal, en 1698, dans son livre « Instruction pour les confitures, les liqueurs et les fruits avec la manière de bien ordonner un dessert » propose déjà d’ajouter de la cochenille pour rougir la compote3. Le colorant issu de la cochenille porte aujourd’hui le nom d’E120 et est présent dans bien des aliments. De la même manière, les Romains utilisaient l’E163 pour colorer leur vin (les anthocyanes, colorants rouge-violets présents dans les baies comme les myrtilles ou les mûres)4. L’utilisation du safran comme colorant est mentionnée dans l’Iliade d’Homère. L’encre de seiche quant à elle est utilisée depuis fort longtemps pour colorer en noir les pâtes. Aussi loin que l’on regarde, nos anciens utilisaient les colorants alimentaires et une multitude d’exemples sont cités dans les livres anciens. Ainsi, on retrouve régulièrement l’usage de jus de carotte, de la mûre, de fleurs divers ou encore du persil1,5.

La cochenille, utilisée par le cuisinier du Roi pour colorer la compote
Mais la coloration a également permis de nombreuses fraudes. Ainsi, au Moyen-Age, la farine blanche était mélangée à de la craie ou des os broyés pour la rendre encore plus blanche. Ceci valu une des premières réglementations britannique en la matière sous le Roi Edward I (1272-1307). En France, on interdit en 1396 de colorer le beurre ou encore les pâtisseries. Dans ces dernières, le jaune permettait de simuler la présence d’œufs.1
La craie dans la farine a finalement de faibles répercutions sanitaires. En effet, le chimiste anglais Friedrich Accum répertoria en 1820 les colorants toxiques utilisés pour les fraudes mais aussi, et tout simplement, ceux utilisés pour rendre beaux les produits. Il mentionna ainsi les cornichons et le ketchup colorés au cuivre, les bonbons colorés au vermillon (colorant contenant du mercure), au plomb (rouge), ou au vert de Scheele (colorant contenant de l’arsenic)6. Mieux vaut éviter la lecture de ce livre si vous voulez continuer à vous faire plaisir en mangeant !

Culinary Poisons. Le livre de la peur
Le Danemark sera une des premières nations à lister les colorants autorisés en 1836 et l’Allemagne suivit en 1887 en interdisant les colorants dangereux. Aux Etats-Unis, en 1880, la moitié des confiseries contenait au moins 1 pigment minéral toxique avec du chrome. Outre l’aspect dangereux et/ou frauduleux de la coloration artificielle, cette dernière a pu provoquer de véritables batailles agro-industrielles. Ainsi, les fabricants de beurre ont exercé de grosses pressions sur les fabricants de margarine pour que celle-ci ne soit pas colorée en jaune1. On retrouve là encore cette influence forte de la couleur sur notre jugement.
Depuis le milieu du XIXème siècle, les colorants naturels ont été remplacés par des colorants de synthèse. Plus de 5000 ont ainsi été inventés4. Certains de ces colorants se sont avérés dangereux pour la santé7 et une législation plus restreinte a été mise en place pour règlementer leur utilisation. De nombreux colorants ont ainsi été interdits dans divers pays, mais les listes des produits prohibés varient d’un pays à l’autre. Dans l’Union Européenne et en Suisse, les colorants autorisés sont répertoriés comme additifs alimentaires, identifiés par un numéro précédé d’un « E ».
Pigments, colorants8,9
Les pigments sont des composés colorés insolubles dans le milieu qui les contient. C’est-à-dire que mélangés à de la peinture, ils resteront en suspension sous forme de particules, comme du sable mélangé à de l’eau. Les pigments sont originaires de minéraux (par ex. oxydes de fer), de plantes tinctoriales (par ex. garance) ou encore d’animaux (par ex. cochenille). Les colorants sont quant à eux solubles dans le milieu qui les contiennent, comme du vin mélangé à de l’eau. Ils sont utilisés surtout dans l’agroalimentaire. On appellera par la suite colorants et pigments sous le terme générique de colorants. En effet, dans l’agro-industrie, le colorant alimentaire peut être n’importe quelle substance qui confère une couleur à ce qu’il est ajouté10.
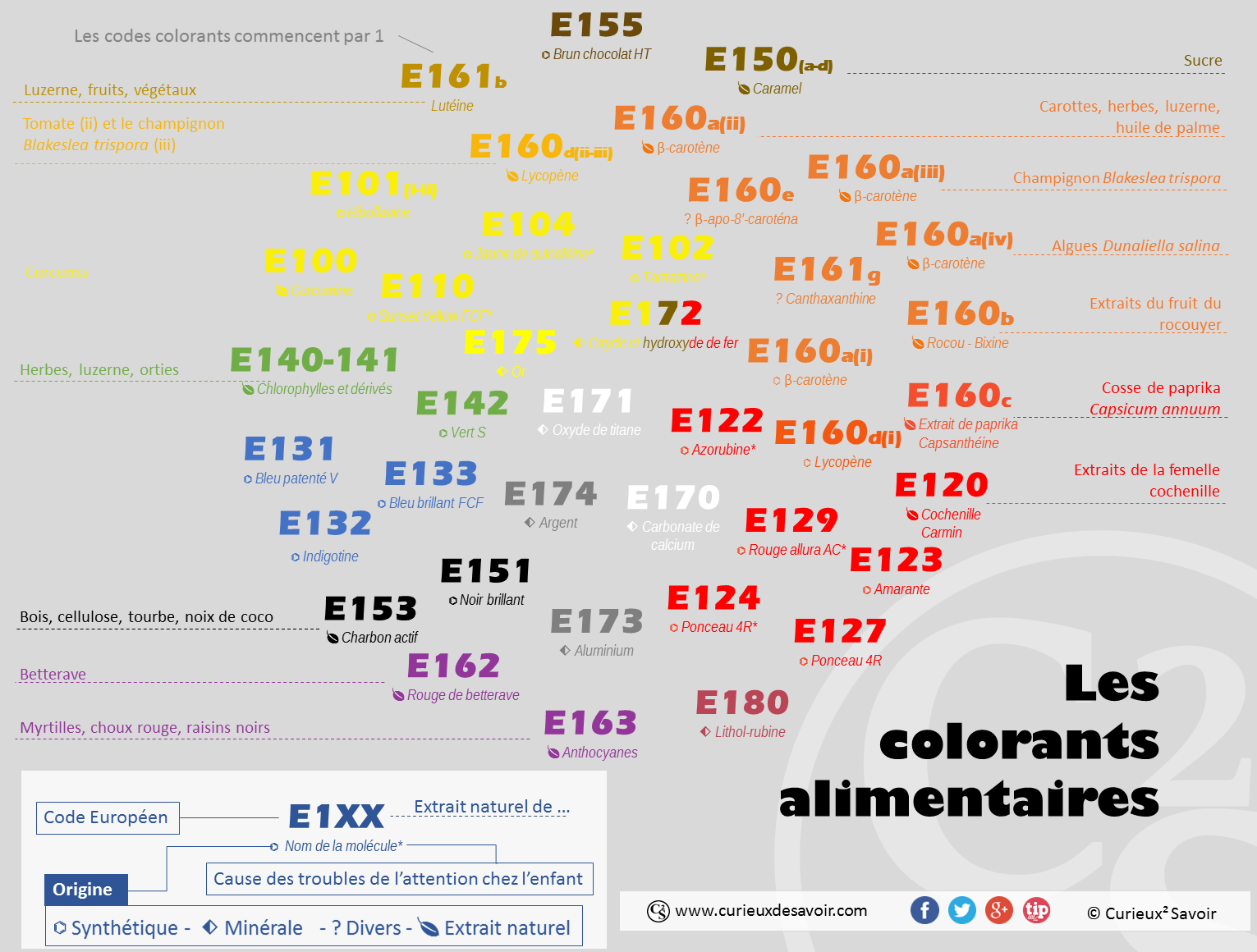
Nomenclature des colorants autorisés en Europe11
Dans l’Union Européenne, les codes de colorants commencent par E1 suivit de deux chiffres (E1XX). L’E142 est par exemple un type très particulier de colorant, nommé le VERT S, qui est une molécule synthétisée chimiquement. L’E162 est le rouge issu des betteraves rouges uniquement (pour les curieux, le nom chimique du composés est donné dans les références12). L’E120 est un colorant rouge issu de la femelle Dactylopius coccus Costa (cochenille : un petit vers). C’est un des rares colorants d’origine animale utilisé dans l’agroalimentaire. L’E153 est un charbon végétal noir qui est obtenu par carbonisation de différents végétaux : noix de coco ou bois par exemple. L’E140 est un mélange vert de chlorophylles, un groupe de molécules issues de diverses plantes (orties, végétaux divers). Tandis ce que l’E163, un colorant bleu-violet-rouge, regroupe la famille des anthocyanes. C’est là aussi un groupe de molécules issus de différentes plantes (raisins rouge, chou, myrtilles etc.)13.
Le code peut être agrémenté de lettre (a,b,c etc.) ou de petits « i » pour apporter plus de précision sur l’origine du colorant. L’E160d est un colorant jaune-orange appelé lycopène. Alors que l’E160d(i) est d’origine synthétique (copie conforme du naturel), le colorant E160d(ii) est originaire de la tomate et l’E160d(iii) est originaire du champignon Blakeslea trispora. Dans le cas du carotène appelé E160 a(i), il n’y a que du b-carotène (une molécule bien précise), alors que son petit cousin, le E160 a (ii), contient des caroténoïdes, c’est-à-dire des mélanges de molécules de la famille des caroténoïdes (b-carotène, astaxanthine, lycopène, lutéine, zéaxanthine). Sous ce nom de colorant, on peut donc avoir des nuances de couleurs, suivant sa composition exacte.
En résumé, les colorants peuvent donc être d’origine synthétique ou naturelle. Certains colorants synthétiques reproduisent un colorant naturel (E160d : lycopène synthétique reproduisant la molécule que l’on retrouve dans la tomate), ou être issus de l’imagination humaine (E131 : Bleu patenté V). L’origine naturelle peut être végétale ou animale. Sous un code de colorant, il peut être regroupé des familles de molécules (chlorophylles, anthocyanes), une molécule précise issue de la chimie (Vert S) ou des extraits naturels plus ou moins purifiés (E160c : extrait de paprika). Les lettres et les mentions « i » peuvent apporter des précisions sur leur origine exacte (extrait précisément d’une algue ou de végétaux divers par exemple).
Les colorants alimentaires
Le Dark Side de certains colorants
Certains additifs alimentaires, et plus particulièrement les colorants alimentaires, sont suspectés depuis près de 50 ans de favoriser le « trouble déficitaire de l’attention avec hyperactivité » des enfants14,15. A ces quelques colorants s’ajoute un conservateur : le benzoate de sodium16. Cette question a été étudiée longtemps et fut sujette à de nombreuses controverses.
En effet, la définition de l’hyperactivité et des troubles de l’attention, la compréhension des mécanismes en œuvre et la mise en place des expérience peuvent s’avérer difficiles2,17,18. On ne peut pas étudier un enfant comme on étudie des rats en cage. Un enfant ne s’enferme pas dans un laboratoire ! Pour mesurer l’hyperactivité des enfants, il est d’abord nécessaire d’impliquer les parents ou les enseignant(e)s. Ces derniers se doivent de compléter des questionnaires précis sur les enfants pendant des semaines. Ensuite, plusieurs groupes d’enfants sont constitués. Certains consomment des cocktails de colorants (et d’un conservateur aussi impliqué) et d’autres des placébos (colorants non concernés). Les comportements des différents groupes d’enfants sont enfin comparés. Au fur et à mesure des années, les preuves se sont accumulées16,18-21, tant et si bien que certains colorants sont désormais amendés d’un avertissement sur les paquets. Les colorants ont des effets aussi bien sur les enfants présentant déjà des troubles (attention, hyperactivité) que ceux n’en présentant pas22. Ceci a poussé certains scientifiques à recommander une élimination de ces colorants (et du conservateur) dans les régimes alimentaires des enfants.22
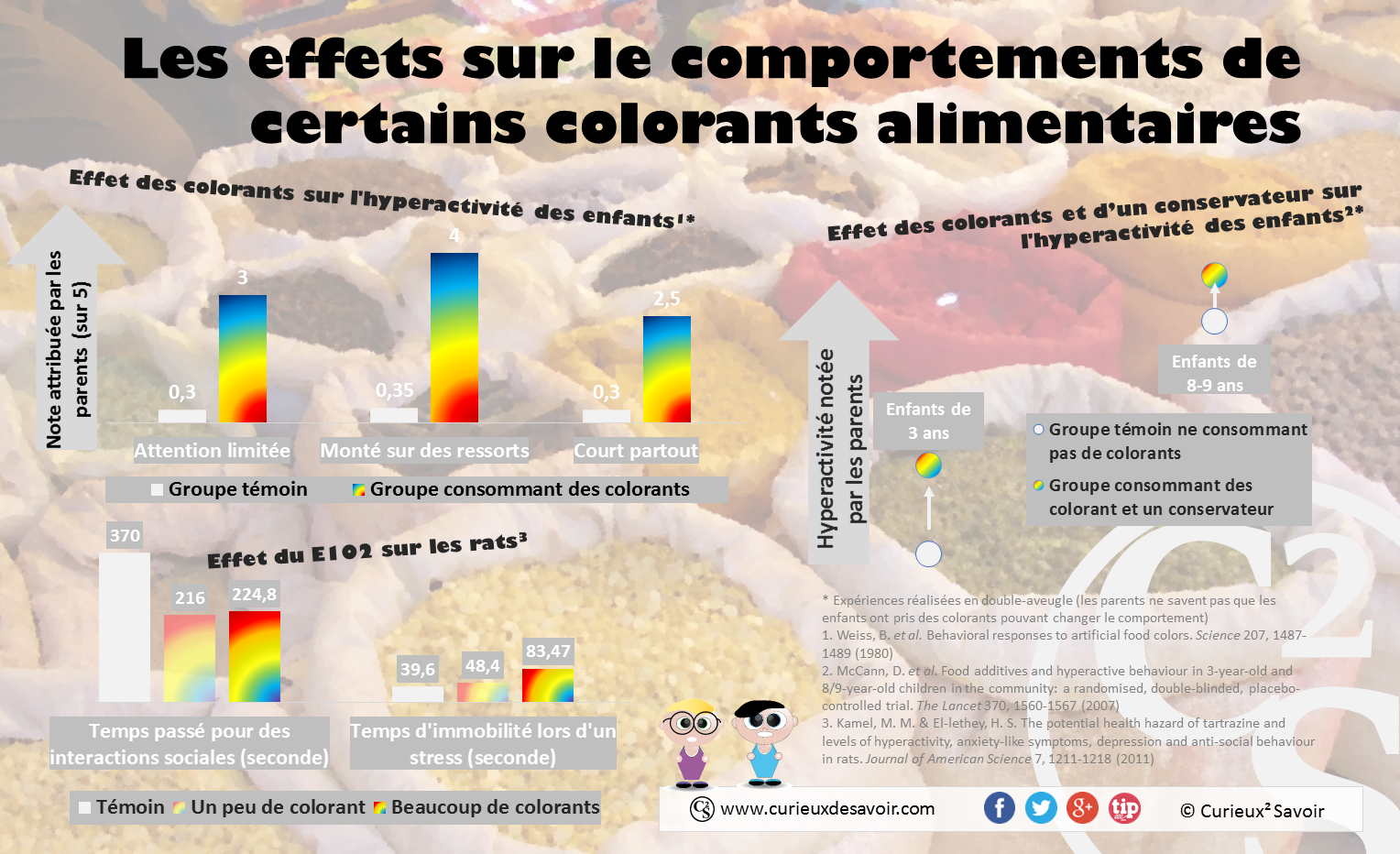
Les enfants présentent une hausse de l’hyperactivité en consommant certains colorants et un conservateur16,20. Chez les rats, l’ingestion de tartrazine (E102) diminue les temps d’interactions et augmente le temps d’immobilité lors de stress. Dans ce cas, la réaction à la nage forcée aboutit à une immobilité des rats, ce qui relève d’un état de dépression. Dépression relevée chez les consommateurs humains de tartrazine.23
Les colorants alimentaires et le conservateur concernés sont :
- La tartrazine (E102) (interdit en UE)
- La Quinoline Yellow (E104)
- Le Sunset Yellow FCF ou jaune-orangé sunset (E110)
- L’Azorubine ou Carmoisine (E122)
- Le Ponceau 4R (E124)
- L’Allura Red AC (E129)
- Le conservateur ayant des effets similaires est le benzoate de sodium (E211)

« Le colorant ponceau 4R peut avoir des effets indésirables sur l’activité et l’attention chez les enfants ». Tel est l’avertissement à la suite de la liste d’ingrédients sur ce seau d’1kg de nappage rouge destiné à la boulangerie.
Aller plus loin
Pourquoi le colorant colore ?
Pour comprendre pourquoi les colorants colorent, il faut comprendre pourquoi nous voyons les objets colorés. Le soleil nous baigne dans une lumière blanche qui est un mélange de lumières de toutes les couleurs. L’arc en ciel est l’illustration la plus connue de cette propriété et peut permettre de convaincre les plus sceptiques. En effet, lorsqu’une lumière traverse les gouttes d’eau tombant du ciel, elle est déviée de sa trajectoire. Mais chaque lumière est déviée de manière différente, nous donnant l’arc en ciel. L’expérience la plus commune pour illustrer cela est de projeter de la lumière blanche sur un prisme (triangle en verre). On voit alors ressortir des faisceaux de lumière de la couleur de l’arc en ciel. Expérience reprise sur la célèbre pochette d’album des Pink Floyd (The dark side of the moon).
Lorsqu’un objet est éclairé par la lumière, une partie des couleurs vont être absorbées par l’objet. Il ne restera ainsi visible que celles n’ayant pas été absorbées. Plus précisément on verra la couleur complémentaire à celle absorbée. Le colorant de la carotte est orange, la couleur absorbée est la couleur complémentaire : le bleu-violet.
Un objet noir absorbera toutes les couleurs, ce qui explique qu’il se réchauffera plus vite au soleil. A contrario, un objet blanc réfléchira l’ensemble des couleurs.
Qu’en est-il des colorants ? Les colorants sont des molécules permettant donc de ne réfléchir qu’une couleur bien précise. Ajouté à un aliment, il lui donnera sa teinte, et ce d’autant plus intensément que le colorant est concentré dans le produit (loi de Beer-Lambert).
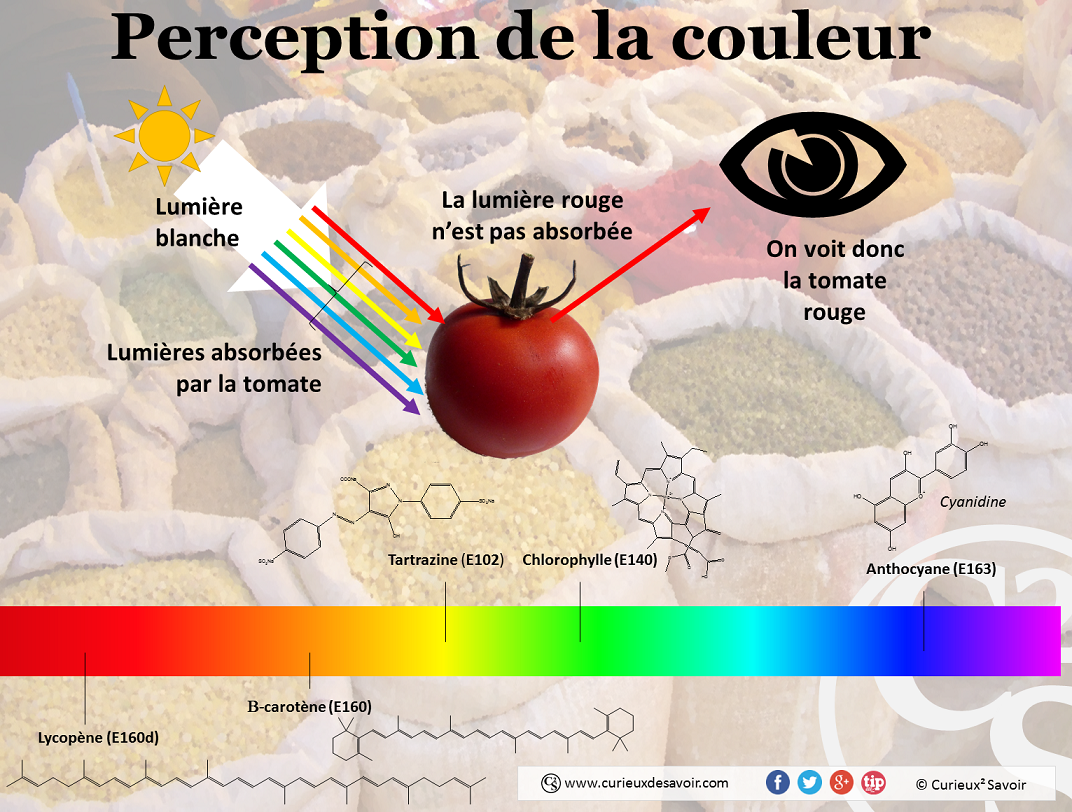 La lumière blanche est composée de toutes les couleurs du spectre, un objet est perçu rouge si les colorants qui le composent n’absorbent pas la lumière rouge.
La lumière blanche est composée de toutes les couleurs du spectre, un objet est perçu rouge si les colorants qui le composent n’absorbent pas la lumière rouge.
Comment les molécules peuvent-elles absorber les rayons de lumière ? Pourquoi certaines molécules sont transparentes, bleues et d’autres oranges ?
La réponse à ces questions réside dans la structure chimique des molécules. En effet, une molécule est composée d’atomes, liés entre eux par des liaisons chimiques. Certains agencements d’atomes et de liaisons sont appelés systèmes conjugués. La présence de ces systèmes conjugués permet aux molécules d’absorber la lumière. Dans l’exemple présenté, la succession des symboles = en rouge représentent le système conjugué. Suivant le nombre de successions, les colorants vont absorber une énergie lumineuse plus ou moins grande, et donc paraître avec une couleur différente.

Suivant la structure de la molécule, la couleur perçue change car la molécule absorbe des lumière différentes.
Phosphoré par : Gontier Adrien, Dujardin Jean-Rémi
Mots clefs : colorants, hyperactivité





